Bloque 2: Diagrama de fases
DEFINICIONES CLAVE:

- Punto triple: determina las condiciones de presión y temperatura (P y T triple) donde coexisten en equilibrio los tres estados de agregación de la materia (sólido, líquido y gaseoso/vapor). Es un punto de equilibrio inestable.
- Punto crítico: determina las condiciones de presión y temperatura (P y T críticas) por encima de las cuales la sustancia pura tiene propiedades intermedias de líquido y gas (fluido súper crítico). Es el último punto de la curva de vaporización. Por encima de la temperatura crítica es imposible la licitación por muy alta que sea la presión aplicada.
- La línea verde es la curva de sublimación (equilibrio entre sólido y gas). Cualquier punto de la curva representa la temperatura de sublimación a una presión determinada.
- La línea azul es la curva de vaporización (equilibrio entre líquido y gas). Cualquier punto de la curva representa la temperatura de ebullición a una presión determinada.
- La línea roja es la curva de fusión (equilibrio entre sólido y líquido). Cualquier punto de la curva representa la temperatura de fusión a una presión determinada.
∆Gº = 0 porque hay equilibrio
P (Presión en atm)
T (Temperatura en ºC)

EVAPORACIÓN
Es el cambio de fase de una sustancia pura de líquido a gas, que se produce a temperatura constante y en equilibrio.

EBULLICIÓN
Es el cambio de estado de líquido a gas que se produce a una temperatura determinada y en toda la masa del líquido se forman burbujas.

CONDENSACIÓN
Es el cambio de fase de una sustancia pura de gas a líquido, que se produce a temperatura constante y en equilibrio.
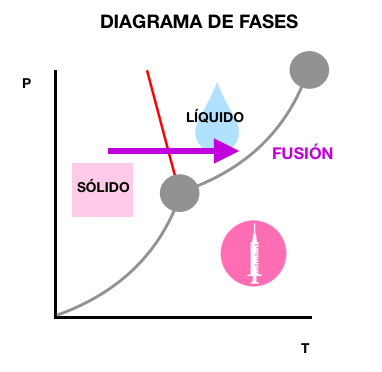
FUSIÓN
Es el cambio de fase de una sustancia pura de sólido a líquido, que se produce a temperatura constante y en equilibrio.

SOLIDIFICACIÓN
Es el cambio de fase de una sustancia pura de líquido a sólido, que se produce a temperatura constante y en equilibrio.

DEPOSICIÓN
Es el cambio de fase de una sustancia pura de gas a sólido, que se produce a temperatura constante y en equilibrio.

SUBLIMACIÓN
Es el cambio de fase de una sustancia pura de sólido a gas, que se produce a temperatura constante y en equilibrio.
PREGUNTAS FRECUENTES:
¿Que representan las líneas que aparecen en un diagrama de fases?
Son los cambios de fase de una sustancia pura a temperatura constante y en equilibrio
EJERCICIOS DE DIAGRAMA DE FASES DE LOS EXÁMENES DE SELECTIVIDAD
- EJ2 S3 2016
- EJ7 S5 2015
- EJ5 S3 2012
- EJ7 S1 2012
Toda la teoría en PDF con el esquema del principio:
Toda la teoría, sin esquemas:
Toda la teoría, con todos los esquemas: