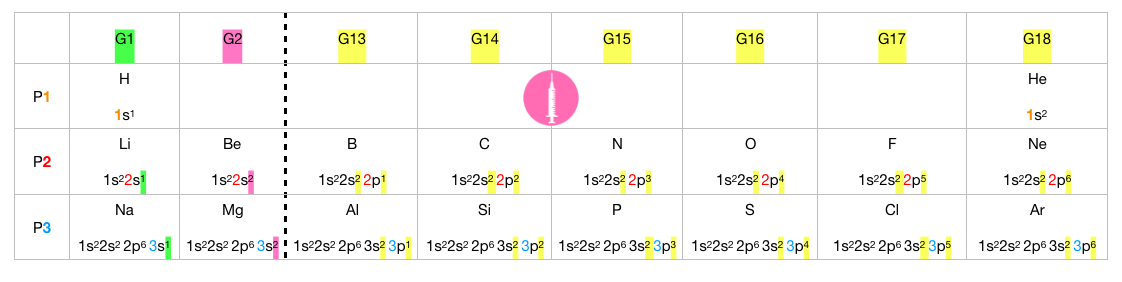
Bloque 3: Propiedades de la tabla periódica
Metales
Metales de transición
No metales
Gases nobles
Orbital atómico: función de onda que nos describe una región del espacio donde hay una alta probabilidad de encontrar un electrón en un determinado estado energético, fijados los números cuánticos l, n y m.
☟Los números cuánticos están casi al final de esta página ☟
PROPIEDADES DE LA TABLA PERIÓDICA :
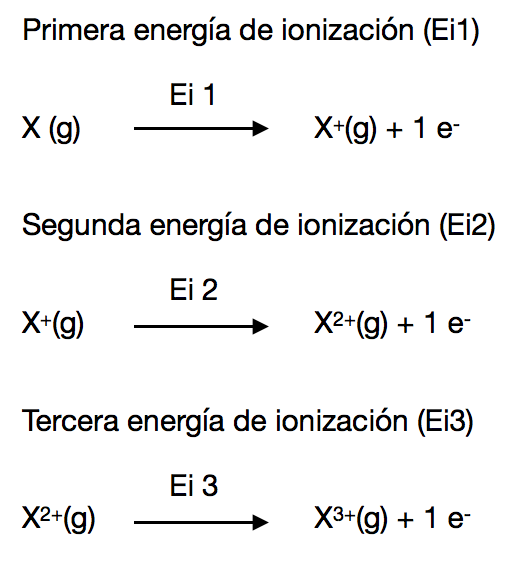
1. Energía de ionización (Ei)
Es la energía mínima necesaria para arrancar un electrón de un átomo en su estado fundamental y en fase gas. Esta es conocida como la primera energía de ionización (Ei1).La segunda energía de ionización (Ei2) es la energía necesaria para arrancar un electrón de un ion con carga +1 en estado gas.
La tercera energía de ionización (Ei3) es la energía necesaria para arrancar en electrón de un ion con carga +2 en estado gas.
Dentro del mismo grupo, cuanto más arriba de la tabla esté el elemento (= menor sea el periodo), más cerca del núcleo estará el electrón que hay que arrancar y menos apantallamiento recibe de los demás electrones porque tiene una energía de ionización mayor.
Dentro del mismo periodo, los elementos tienen en el mismo nivel energético (orbital) el electrón que hay que arrancar. Cuanto más a la derecha de la tabla esté ( = mayor sea el grupo), mayor será el nº atómico y la carga nuclear, por lo tanto, la Ei será mayor.
2. Electronegatividad (En)
Es la tendencia que tiene un átomo de este elemento para atraer un electrón hacia él cuando forma parte de un enlace químico.
Dentro del mismo grupo, la En es mayor cuanto menor sea el periodo.
Dentro del mismo periodo, la En es mayor cuanto mayor sea el grupo.
3. Afinidad electrónica (Eaf)
Es la energía intercambiada cuando un átomo en fase gas y en estado fundamental capta un electrón.
Dentro del mismo grupo, la Eaf es mayor cuanto menor sea el periodo.
Dentro del mismo periodo, la Eaf es es mayor cuanto mayor sea el grupo.
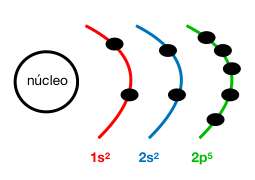
4. Radio atómico
Se considera la mitad de la distancia entre los dos núcleos de dos átomos de un mismo elemento que formen una molécula biatómica, una estructura covalente o una estructura con enlace metálico. También se conoce como la distancia entre el núcleo y el último orbital o electrón.

- DIAGRAMA DE MÖELLER
La letra detrás de cada número representa el orbital atómico. Puede ser s, p, d o f.
Los números subrayados en naranja representan cuántos electrones caben en cada orbital. En cada orbital s hay espacio para 2 electrones, en el orbital p hay para 6 electrones, en el orbital d hay para 10 electrones y en el orbital f hay espacio para 14 electrones.
NÚMERO ATÓMICO (N)
Cada elemento de la tabla periódica tiene un número atómico. Lo dan en los exámenes y sirve para poder utilizar el diagrama de Möeller y poder hacer la configuración electrónica de ese elemento.
CONFIGURACIÓN ELECTRÓNICA
ORBITAL ATÓMICO. ¿CÓMO SON LOS ORBITALES?
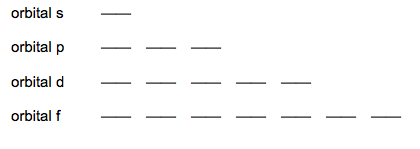
Este se podría considerar un esquema de cada tipo de orbital (s, p, d y f) y de cuántos electrones se pueden poner en cada uno. En cada línea hay espacio para dos electrones, que se simbolizan con flechas para arriba y para abajo. Primero se rellenan de izquierda a derecha con flechas hacia arriba y una vez se completan los espacios con las flechas hacia arriba, se empieza por la izquierda otra vez a rellenar espacios pero con flechas hacia abajo.
¿CÓMO PUEDO HACERLO?
Primero de todo vamos a estudiar cómo es el orbital p. Tiene tres "espacios" y en cada espacio caben dos electrones. Por lo tanto en los orbitales p (2p, 3p,...) hay sitio para 6 electrones (indicado en naranja en el diagrama de Möeller).
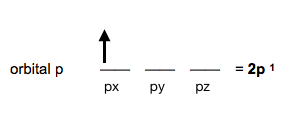
Si en el orbital 2p solo hay un electrón, pasará a llamarse orbital 2p¹.
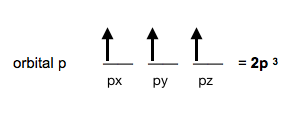
Si en el orbital 2p hay 3 electrones, pasará a llamarse orbital 2p³.
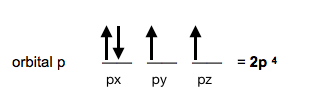
Si en el orbital 2p hay 4 electrones, pasará a llamarse orbital 2p⁴.
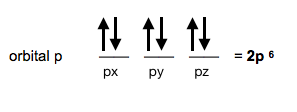
Si en el orbital 2p hay 6 electrones, pasará a llamarse orbital 2p⁶.
El orbital 2p⁶ es un orbital completo porque contiene todos los electrones que pueden haber en ese orbital p (6 electrones). Costará más arrancar un electrón de un orbital completo que de otro orbital 2p que no esté completo.
Cuando los orbitales están llenos o completos son más estables.
Cuando los orbitales no están llenos son menos estables.
Estos ejemplos de los orbitales 2p con las flechas podrían ser perfectamente cualquier otro orbital p (3p, 4p, 5p, 6p y 7p). Los he llamado 2p por la comparación siguiente:
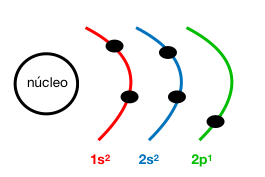
Configuración electrónica: 1s²2s²2p¹
Z (B) = 5
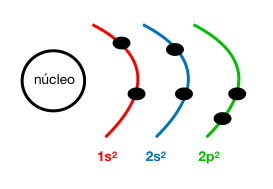
Configuración electrónica: 1s²2s²2p²
Z (C) = 6
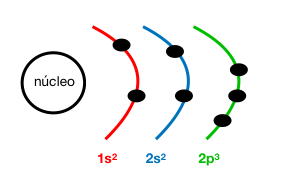
Configuración electrónica: 1s²2s²2p³
Z (N) = 7
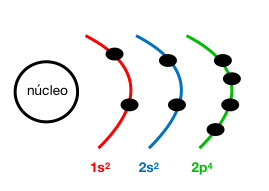
Configuración electrónica: 1s²2s²2p⁴
Z (O) = 8
Configuración electrónica:1s²2s²2p⁵
Z (F) = 9
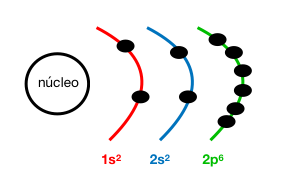
Configuración electrónica: 1s²2s²2p⁶
Z (Ne) = 10
NÚMEROS CUÁNTICOS:
- Principal: n: nivel de energía. Equivale al periodo (va del 1 al 7).
- Secundario: l (L minúscula): subnivel de energía y forma del orbital (va de 0 a n-1). También conocido como el número cuántico del último electrón.
l = 0, orbital s
l = 1, orbital p
l = 2, orbital m
l = 3, orbital f
- Magnético: m: orientación en el espacio y nº de orbitales (va de -l a +l)
- Spin: s: puede ser + 1/2 o - 1/2
COMPARACIÓN DE RADIOS ATÓMICOS:
El primer paso antes de empezar a comparar los radios atómicos es hacer la configuración electrónica de aquello que se tiene que comparar.
Resumen / Truco para la configuración electrónica: