Bloque 4: Espectroscopía
ESPECTRO: gráfica que representa la absorción de energía de un determinado compuesto en función de la longitud de onda o la frecuencia de radiación utilizada.
4.1. Infrarrojo
Técnica de determinación de un compuesto basada en la radiación de la muestra con la radiación IR de manera que provoca la excitación de la molécula desde un nivel vibracional fundamental a un nivel vibracional excitado, provocando la deformación de los enlaces que vibran a una determinada 𝝺, N o 𝝊.
Absorción de radiación IR
Cuando una molécula absorbe radiación infraroja se producen cambios de energía vibracional de la molécula (cambios en la vibración de los enlaces de la molécula). La energía de este tipo de radiación es capaz de provocar un salto desde el nivel fundamental de energía vibracional a un nivel excitado.
Qué observamos en un espectro IR?
En un espectro IR de una sustancia observamos una serie de picos que estan relacionados con los diferentes tipos de enlaces que hay entre los átomos de la molécula (vibración). Por lo tanto, nos da información de los grupos funcionales de la sustancia.
Qué información aporta?
Nos aporta información sobre qué tipo de enlaces hay en una molécula.
Una posible respuesta para un examen:
Cuando una molécula absorbe radiación IR se producen cambios de energía vibracional debido a las deformaciones de los enlaces por tensión y flexión. La energía de este tipo de radiación es capaz de provocar un salto desde el nivel fundamental de energía vibracional a un nivel excitado. El espectro IR obtenido por una molécula se caracteriza por una serie de picos, de diferentes alturas, que corresponden a diferentes transiciones vibracionales de los enlaces de la molécula.
Además de aprenderse la teoría, hay que saber qué vamos a encontrar en el examen. Suelen salir un tipo concreto de gráficas y podéis encontrar diferentes parámetros (es decir, que en el eje x o y podéis encontrar diferentes unidades, pero seguirán siendo espectros de IR).
Sabemos que es imprescindible analizar en contenido de la gráfica, aquello que se está representando, pero cuidado con las unidades... Os recomiendo que antes de nada os fijéis en los ejes. En todos los exámenes que he hecho he subrayado el parámetro de los ejes y las unidades !!
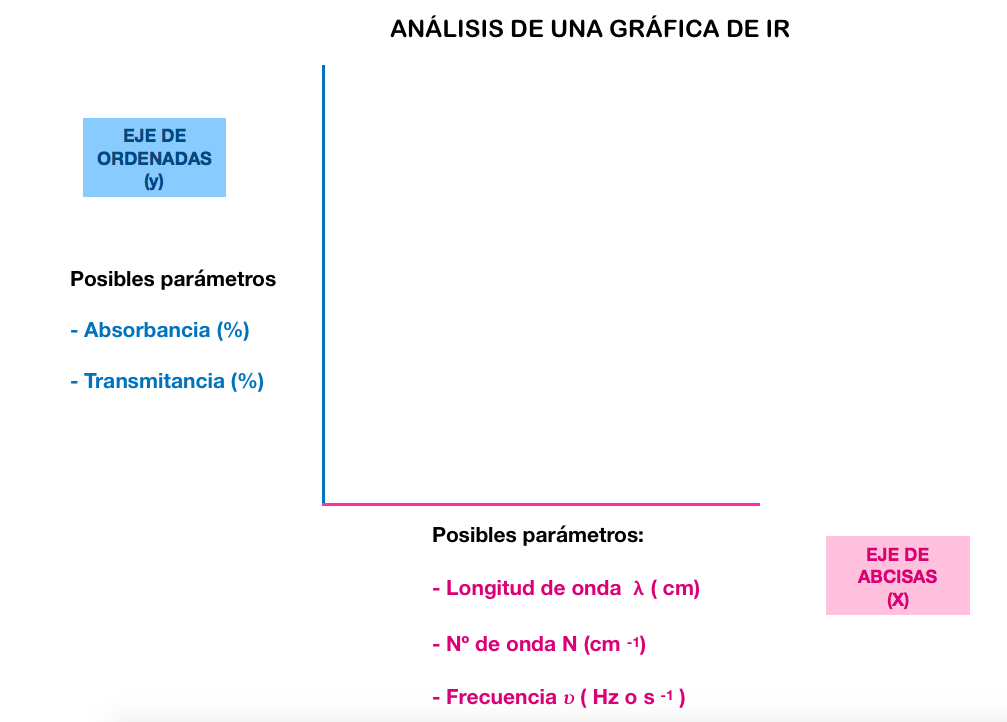
Es importante fijarse en las unidades, porque puede que en la gráfica salgan unas unidades y pueden pedir los resultados con otras unidades. Esto pasará principalmente con el eje de abcisas. Existe una fórmula para poder hacer la conversión a las unidades que necesitemos:
4.2. Espectrometría de masas
Es una técnica de análisis de determinación de un compuesto que consiste en irradiar una molécula previamente volatilizada de una manera que primero pierde un electrón (e-), formando el pico molecular (M+) y se continua fragmentando dando lugar a los picos consecutivos en el espectrómetro de masas.
Qué le pasa a una molécula cuando se somete a EM?
La molécula se fragmenta formando diversos iones positivos (a veces uno de los iones es el ion molecular M+).
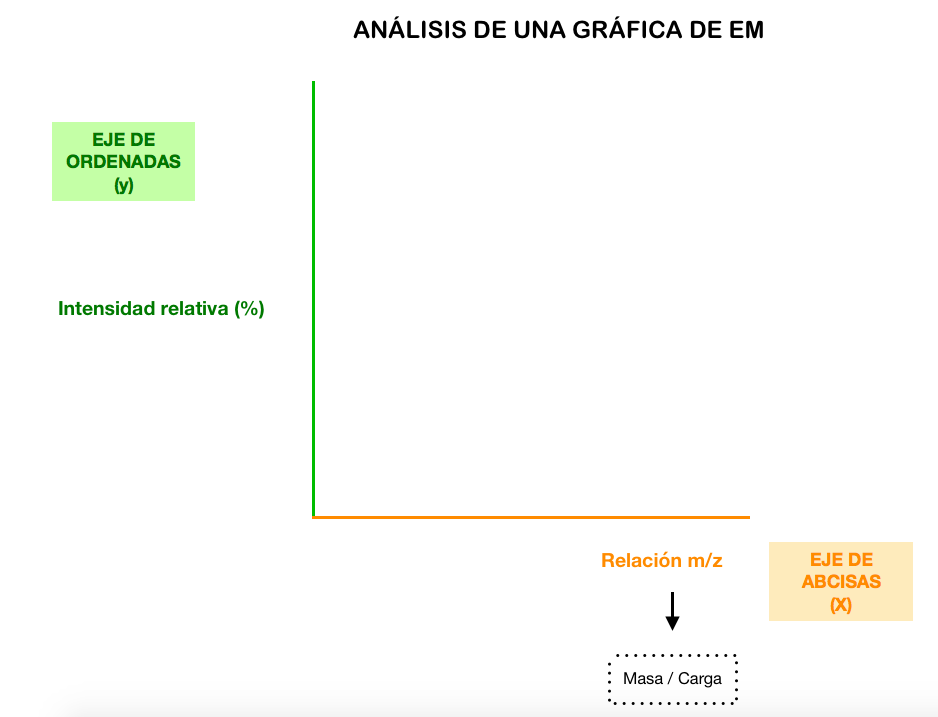
Qué se detecta en la EM?
Se detectan un conjunto de iones con una determinada relación masa/carga que provienen de la fragmentación de la molécula original.
Qué información aporta?
El estudio de los iones que aparecen en EM permiten:
- determinar qué molécula tenemos en nuestra muestra.
- determinar el peso molecular de la molécula.
En este tipo de gráficas también es importante fijarse en los ejes: